ABCSG 55N / AMBHER Studiendetails
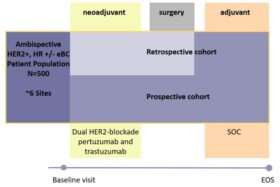
Eine nicht-interventionelle, einarmige, multizentrische Studie mit ambispektivem Studiendesign zur Beschreibung von PatientInnen mit HER2 positivem Brustkrebs, die neoadjuvant behandelt werden, und Entwicklung einer dynamischen Risikobewertung, um das Risiko von Fernmetastasen vorherzusagen.
Studienstart:
FPI voraussichtlich 02/2023
Coordinating Investigator:
Marija Balic, Graz
Status:
offen
Stichprobenumfang:
500 (national)
Studiendesign:
Primäres Studienziel:
Entwicklung eines Models, um das Risiko von PatientInnen mit frühem HER2-positivem Brustkrebs, die eine neoadjuvante Therapie mit Pertuzumab in Kombination mit Trastuzumab erhalten, an einem Fernrezidiv zu erkranken, vorherzusagen.
Sekundäres Studienziel:
Evaluierung der kardiologischen Sicherheit von Pertuzumab und Trastuzumab in Kombination mit Standardchemotherapie im neoadjuvanten Setting in PatientInnen mit HER2-positivem Brustkrebs
Exploratives Studienziel:
(Neo-)adjuvante Behandlungsmuster in der realen Welt – Das im primären Studienziel erwähnte Risikomodel soll dabei helfen, PatientInnen mit einem klinischen Vorteil durch die adjuvante Gabe von Pertuzumabz zu identifizieren, im Sinne einer Annäherung an die Präzisionsmedizin. Daher ist das Verständnis des relativen Ausmaßes der neoadjuvanten und adjuvanten Behandlung von Bedeutung, inklusive Trastuzumab, Trastuzumab Biosimilars, Pertuzumab und TM-D1. Ein adjustierter Vergleich soll anschließend dabei helfen, die potenzielle Auswirkung einer Reduktion nachfolgender Kosten im metastasierenden Setting, durch Prävention weiterer Fernrezidive mittels intensivierter adjuvanter Therapie, einzuschätzen.
Translationales Studienziel
Etablierung einer Biobank mit HER2-positivem Tumorgewebe und zugehörigen Biomarker Untersuchungen.
Einschlusskriterien:
- Weibliche und männlich PatientInnen, die mind. 18 Jahre alt sind
- Unterzeichnete Einverständniserklärung
- Histologisch bestätigtes Adenokarzinom der Brust
- HER2+ Erkrankung, entweder als 3+ Immunohistochemie oder 2+ Immunohistochemie und HER2 Amplifikation mittels In Situ Hybridisierung (ISH)
- PatientInnen mini- / bilateralem Brustkrebs müssen mindestens eine HER2+ Läsion aufweisen
- Prospektive PatientInnen: mindestens eine Dosis neoadjuvanter Therapie mit dualer HER2 Blockade wurde verabreicht oder Verabreichung derselben ist geplant, wenn die/der PatientIn vor Therapiestart in die Teilnahme eingewilligt hat.
- Retrospektive PatientInnen: mindestens eine Dosis neoadjuvanter Therapie mit dualer HER2 Blockade wurde verabreicht, gefolgt von der definitiven Operation
- Anti-Her2 Therapie wurde maximal 5 Jahre vor der Registrierung in die Studie begonnen
Ausschusskriterien:
- Metastatische oder lokal fortgeschrittene Erkrankung (mit loko-regionaler Behandlungsoption mit kurativer Intention) zum Zeitpunkt der Diagnose
- Vorhergehende Behandlung derselben Erkrankung mit einer Therapie, die nicht der im Rahmen der NIS untersuchten, entspricht
Teilen auf